적 요나도국수나무족에 속하는 Neillia속(나도국수나무속) 4종 4변종, Physocarpus속(산국수나무속) 5종, Stephanandra속(국수나무속) 2종을 포함, 총 3속 15분류군의 잎 표피 미세형태학적 형질을 주사전자현미경 (scanning electron microscope)을 이용하여 관찰 및 기재하였으며, 형질의 분류학적, 계통학적 유용성을 검토 하였다. Neillia속, Stephanandra속에서 기공복합체는 모두 배축면에만 존재하는 이면기공엽(hypostomatic type)이 나타났고, Physocarpus속에서는 P. monogynus, P. opulifolius에서만 양면기공엽(amphistomatic type)이 나타났다. 공변세포의 크기는 12.02−34.39 × 10.76−27.13 µm로 속과 종마다 다소 차이를 보이는데, N. thyrsiflora가 평균 13.98 × 12.43 (L × W) µm로 가장 작은 공변세포를 갖는 것으로 나타났으며, N. gracilis가 평균 26.82 × 20.67 (L × W) µm로 가장 크게 나타났다. 기공복합체의 형태는 N. affinis에서만 평행형 (paracytic)이 나타났고, 대부분 불규칙형(anomocytic)이 확인되었다. 표피세포는 섬국수나무(Physocarpus insularis)에서만 배축면에서 유두상(papillate)이 관찰되어 구별되었으며, N. affinis, S. tanakae의 향축면에서 판형(platelets)의 표피상납질(epicuticular wax)이 나타나 구별되었다. 한편, 연구된 분류군에서 모용은 크게 단세포단모(unicellular non-glandular trichome), 2−5개 가지상 모용(two- to five-armed trichome), 성상모 (stellate), 선모(glandular trichome), 총 4종류로 확인되었다. 특히, 섬국수나무를 제외한 Physocarpus속 모든 분류군에서 성상모가 나타나 구별되었다. 끝으로, 잎 표피 미세형태학적 형질 중 기공복합체의 형태, 유두상 표피세포의 유무, 성상모의 유무 형질이 분류학적 및 계통학적으로 유용성이 있음을 밝혔고, 본 연구 결과, Stephanandra속의 Neillia속으로의 통합, 섬국수나무(Physocarpus insularis)의 Spiraea속(조팝나무속)으로의 전 속을 주장한 이전의 분자계통학적 및 화분학적 연구 결과를 강력하게 지지하였다.
AbstractA comparative study of the leaf epidermal micromorphology in the tribe Neillieae (Neillia: 4 species, 4 varieties; Physocarpus: 5 species; Stephanandra: 2 species) was carried out using scanning electron microscopy in order to evaluate the taxonomic and systematic implications of these characteristics. The leaves of the genera Neillia and Stephanandra were hypostomatic, whereas those of P. monogynus, P. opulifolius were amphistomatic. The range of the size of the stomata is 12.02−34.39 × 10.76−27.13 µm; the smallest was found in N. thyrsiflora (average 13.98 × 12.43 µm; L × W), while the largest was measured in N. gracilis (average 26.82 × 20.67 µm; L × W). Paracytic stomata complexes are only found in N. affinis, and the anomocytic type was most commonly found. The papillate epidermal cell type was only observed on the abaxial surfaces of P. insularis. Platelet epicuticular waxes were found on the adaxial surfaces of N. affinis and S. tanakae. Four types (unicellular non-glandular, two- to five-armed, stellate, and glandular) of trichomes were found on the leaves. Stellates were observed in all species of Physocarpus except for P. insularis. Consequently, leaf epidermal micromorphological characteristics (e.g., the presence of papillate epidermal cells and stellate, and stomata complexes) may have high taxonomic and systematic value in Neillieae. Our results strongly support previous molecular phylogenetic and palynological hypotheses that Stephanandra and Neillia are a single genus and that Physocarpus insularis should be considered as a member of Spiraea.
(tribe Neillieae Maxim.)은 장미과(family Rosaceae Juss.) 내의 조팝나무아과(subfamily Spiraeoideae Agardh)에 속하는 분류군으로 Neillia D. Don (나도국수나무속), Physocarpus (Cambess.) Raf. (산국수나무속), Stephanandra Siebold & Zucc. (국수나무속)를 포함한 약 18분류군으로 구성된다(Maximowicz, 1879; Schulze-Menz, 1964). 본 족은 주로 동아시아와 북미 등 북반구 온대지역에 분포하는데, 특히 Neillia속, Stephanandra속, Physocarpus amurensis는 동아시아에 제한적으로 분포하고, P. alternans, P. capitatus, P. malvaceus, P. monogynus는 북미 서부에 자생하며, P. opulifolius는 북미 동부에 분포한다(Oh and Potter, 2005). 본 족에 속하는 분류군은 관목, 결각상의 호생하는 단엽, 숙존성 또는 낙엽성 탁엽의 존재, 골돌과 내 많은 양의 배유를 갖는 종자 등, 조팝나무족, 쉬땅나무족 등의 과 내 다른 분류군과 구별되는 형질을 지닌다(Vidal, 1963; Kalkman, 2004).
최근 수행된 분자계통학적 연구 결과에서는 장미과 내 나도국수나무족의 단계통을 강력히 지지하고 있으나(Morgan et al., 1994; Potter et al., 2002; Oh and Potter, 2005), 족 내 속간 한계 설정에 대해서는 학자 간의 의견이 다양하다. Bentham and Hooker (1865), Greene (1889), Jones (1893)는 나도국수나무족이 2개의 속(Neillia속[Physocarpus속 포함], Stephanandra속)으로 이루어진 것으로 규정한 반면, Kuntze (1891)는 족에 포함되는 세 속을 Physocarpus 하나의 속으로 인식하였다. 대부분의 학자들은 전통적으로 본 족을 Neillia속, Physocarpus속, Stephanandra속, 3개의 속으로 인식하였고, 최근까지도 나도국수나무족은 3개의 속으로 인식되어 왔다(Rehder, 1940; Schulze-Menz, 1964; Robertson, 1974; Takhtajan, 1997; Kalkman, 2004).
하지만, 가장 최근에 수행된 엽록체 DNA, 핵 DNA, LEAFY를 이용한 분자계통학적 연구에서는 Stephanandra 속이 Neillia속으로 유합되는 결과를 통해 두 속의 통합을 제안하였고(Oh and Potter, 2003, 2005), Stephanandra속이 Neillia속으로 통합되며 Stephanandra속 내 분류군들이 명명법적 규약에 의거하여 재조합되었다(Oh, 2006). 이처럼, 가장 최근의 장미과 분류체계에서는 본 족을 Neillia속과 Physocarpus속 두 속으로 인식하고 있다(Potter et al., 2007). 한편, 나도국수나무족 산국수나무속 내에 포함되는 분류군인 섬국수나무[Physocarpus insularis (Nakai) Nakai]는 최근까지도 분류학적 위치에 대한 다양한 의견이 있어 왔다. Kim et al. (2000)은 형태학적 형질을 통해 섬국수나무를 Spiraea chamaedryfolia L. var. ulmifolia (Scop.) Maxim. (인가목조팝나무)의 이명으로 처리하였고, Oh et al. (2010)은 형태학적, 분자계통학적 결과의 종합적 고찰을 통해 섬국수나무를 Spiraea L. (조팝나무속) 내에 포함되나, 인가목조팝나무와는 다른 종으로 구별하여 인식하였다. 그 결과, 섬국수나무는 Physocarpus속에서 Spiraea속으로 전속되어, S. insularis (Nakai) H. Shin, Y. D. Kim & S. H. Oh로 재조합되었다(Shin et al., 2011).
하지만, 섬국수나무를 포함한 본 족에 대한 연구는 일부 외부형태와 분자계통학적 형질에만 국한되어있고, 미세형태학적 형질에 대한 연구는 미비한 실정이다. 잎 표피, 꽃잎 표피, 종자 표면 등의 미세형태학적 형질은 해당 식물군의 진화와 분류, 계통학적 해석에 있어 유용한 정보를 제공해주며, 나아가 피자식물군 전체의 종합적인 이해를 돕는다(Dahlgren, 1980; Moïse et al., 2005). 특히, 잎 표피 미세형태학적 형질은 형질의 기재 및 분류학적 유용성이 이미 검증된 바 있으며(Wilkinson, 1979; Stace, 1984), 최근까지도 이와 같은 분류학적 유용성을 근거로 오미자과(Yang and Lin, 2005), 가지속(Anil Kumar and Murugan, 2013), 토끼풀속(Zoric et al., 2009), Cyclobalanopsis아속(Deng et al., 2014), Glyptostrobus pensilis (Ma et al., 2004) 등 다양한 분류군의 다양한 분류학적 계급 내에서 분류학적 및 계통학적으로 적용되어 왔다. 한편, 잎 표피에서 관찰할 수 있는 형질들 가운데 기공의 형태와 밀도, 모용의 종류와 분포 및 표피상납질의 유무 등은 박하족(Moon et al., 2009), 쉬땅나무족(Song and Hong, 2016), 양지꽃족(Heo et al., 2013), 토끼풀족(Taia, 2004), Crotoneae족(De Sá-Haiad et al., 2009), Saturejeae족(Husain et al., 1990) 등 족 수준에서 속간 또는 종간 분류학적 유용성이 검증되었다.
이에, 본 연구에서는 나도국수나무족 3속 15분류군을 대상으로 주사전자현미경(scanning electron microscope, SEM)을 이용하여, 잎 표피에서 확인할 수 있는 기공, 표피세포, 표피상납질, 모용 등의 미세형태학적 형질을 살펴보고자 하였다. 따라서, 본 연구는 나도국수나무족에 포함되는 분류군의 잎 표피 미세형태를 상세히 관찰하고, 기재하며, 확인된 잎 표피 미세형태학적 형질과 최근 분자계통학적 연구와의 비교 고찰을 통해 형질의 계통학적 유용성 및 족 내 속간 진단형질로서의 가치를 파악하고자 처음으로 시도되었다. 또한, 최근 Spiraea속으로 전속된 섬국수나무와 Spiraea속 분류군 잎 표피 연구와의 비교를 통해 섬국수나무의 분류학적 위치에 대한 타당성을 확인하는 데 그 의의가 있다.
재료 및 방법본 연구에서는 Neillia속(나도국수나무속) 4종 4변종, Physocarpus속(산국수나무속) 5종, Stephanandra속(국수나무속) 2종, 총 3속 15분류군의 석엽 표본 또는 생체 표본을 국내·외 표본관(KB, KHUS, WU, abbreviations according to Thiers, 2017)으로부터 대여하거나 직접 채집하여 사용하였으며, 실험에 사용된 확증표본은 Appendix 1에 제시하였다.
성숙한 잎을 선별하고, 모용과 선점을 관찰하기 위해 해부현미경(streomicroscope, SteREO Discovery. V8, Carl Zeiss Microscopy GmbH, Jena, Germany)을 사용하였으며, 주사전자현미경(SEM)을 이용하여 잎 표피 미세형질들을 관찰하였다. 야외에서 직접 채집된 생체표본은 FAA (40% formalin: 40% glacial acetic acid: 70% ethyl alcohol) mixture에 고정 후 장기 보관하여 사용하였고, 이미 건조된 표본이나, 대출표본으로부터의 재료는 약 90ºC에서 3분간 끓이거나 연화제(Agepon, Agfa Gevaert, Leverkusen, Germany; Agepon wetting agent : distilled water, 1 : 200)에 넣어, 24시간 이상 담가 조직을 부드럽게 한 후, 70% alcohol에 보관하여 실험에 사용하였다. 잎의 미세형태학적 형질을 관찰하기 위해서 70% alcohol에 보관된 시료는 아세톤시리즈(acetone series: 50%, 70%, 90%, 100%에서 각각 약 1시간 정도 보관)를 거쳐 탈수한 후, 이산화탄소(CO2) 가스를 이용한 임계점 건조 처리(critical point drying; SPI-13200J-AB, SPI Supplies, West Chester, PA, USA)를 하여 완전 건조시켰다. 건조된 시료는 알루미늄 스터브(aluminum stub) 위에 올린 다음 이온 증착기(Ion-Sputter, JFC-1100, JEOL, Tokyo, Japan)를 이용하여 백금(Pt)으로 2분간 이온증착(ion-coating)하였으며, 전계방출형 주사전자현미경(field emission scanning electron microscope; FE-SEM, S-4700, Hitachi, Tokyo, Japan)으로 WD (working distance) 10−12mm와, 가속전력 10 kv에서 관찰하였다. 기공의 크기와 모용의 길이는 Macnification program (2.0 version, Orbicule, Leuven, Belgium)으로 측정하였고, 기공의 크기는 25개를 최소단위로 측정하여, 최소−(평균)−최대값으로 나타냈으며, 기공의 밀도는 일정 면적(0.05 mm2)에 분포하는 수를 세었다. 또한, 기공의 길이(L), 너비(W), 밀도(D) 간의 관계를 파악하기 위해 피어슨 상관관계(Pearson correlation)를 이용하여 분석하였다(IBM SPSS Statistics for Windows, version 19.0, Released 2010, IBM Corp., Armonk, NY, USA).
잎 표피 미세형질에 관한 용어는 Wilkinson (1979), Barthlott (1981), Stace (1984)를 주로 따랐고, 모용의 형태는 Theobald et al. (1979)을 참고하였다.
결 과기공복합체(stomatal complex)의 유형나도국수나무족 분류군의 기공복합체는 Neillia속, Stephanandra속에서 배축면(abaxial surface)에만 기공이 존재하는 이면기공엽(hypostomatic type)이었고, Physocarpus 속에서는 P. monogynus, P. opulifolius에서만 배축면과 향축면(adaxial surface) 모두에 기공이 존재하는 양면기공엽(amphistomatic type)으로 나타났다(Fig. 2A, B, Table 1). 공변세포의 크기는 12.02−34.39 × 10.76−27.13 μm로 분류군에 따라 다소 차이를 보이는데, N. thyrsiflora가 평균 13.98 × 12.43 (L × W) μm로 가장 작은 공변세포를 갖는 것으로 나타났으며, N. gracilis가 평균 26.82 × 20.67 (L × W) μm로 가장 크게 나타났다(Table 1). 기공의 길이(L)와 너비(W) 간에는 유의한 수준으로 양의 상관관계를 나타냈고(L과 W: r = 0.72, p < 0.001), 기공의 길이와 너비는 밀도(D)와 유의한 수준으로 음의 상관관계를 나타냈다(L과 D: r = -0.50, p < 0.001; W와 D: r = -0.28, p < 0.05). 기공복합체의 형태는 대부분의 분류군에서 불규칙형(anomocytic)이 관찰되었으며(Table 1), N. affinis에서만 평행형(paracytic)이 나타났다(Fig. 1A).
표피세포(epidermal cell)의 미세형태 및 표피상납질의 유무표피세포의 형태는 연구된 모든 분류군에서 등방형(isodiametric)으로 나타났고, 부세포의 수층벽(anticlinal wall)은 Neillia속의 향축면에서 모두 직선형과 곡선형이 동시에 관찰(straight/curved)되었으며, 배축면에서 파상형(undulate)이 나타났고(Fig. 1A, G), Physocarpus속에서는 직선형(straight), 곡선형(curved), 파상형이 동시에 나타났다. 반면, Stephanandra속에서는 향축면, 배축면 모두에서 파상형이 관찰되었다(Table 2). 병층벽(periclinal wall)의 형태는 대부분의 분류군에서 향축면, 배축면에서 편평(flat)하게 나타났지만, 섬국수나무(P. insularis)의 배축면에서만 유두상(papillate)이 나타났으며(Fig. 1I−J), Stephanandra속내 분류군의 배축면에서는 볼록(convex)하게 나타났다. 표피세포의 표면(fine relief)은 매끈하거나(Fig. 1K), 유선상의 표면을 지닌다(Fig. 1B, E, Table 2).
모용(trichome)의 유형연구된 15분류군의 잎 표피에는 향축면과 배축면에 다양한 종류의 모용이 분포하는 것으로 밝혀졌다. 비선모 모용은 단세포 단모(simple unbranched unicellular non-glandular trichome)와 2−5개 가지상 모용(two- to five-armed trichome), 성상모(stellate)가 나타났고, 선모(glandular trichome)는 짧은 자루의 두상선모(capitate glandular trichome)와 자루가 없는 두상선모(subsessile glandular trichome)가 나타났다. 모용의 종류에 따라 다음의 type과 subtype으로 구별하였다(Table 2).
1. Type 1. 단세포 단모단세포성 단모로, 표면이 매끈하며, 모용의 길이에 따라 2가지 subtype으로 구별된다.
3. Type 3. 성상모6개 이상의 가지로 구성된 별 모양(star-shaped)의 비선모로 성상모를 이루는 ray (가지상 단모)의 빈도와 모양에 따라 2가지 subtype으로 구별된다.
고 찰나도국수나무족 3속 15분류군에 대하여 잎 표피 미세형태학적 형질(기공복합체의 유형, 공변세포의 크기, 표피세포의 미세형태 및 표피상납질의 유무, 모용의 유형)을 자세히 관찰하고, 기재하였다. 연구된 분류군에서는 기공복합체의 유형, 표피세포의 미세형태, 모용의 유형에서 형질의 다양성을 확인하였으며, 분류학적 및 계통학적 유용성을 고찰하였다.
기공복합체의 유형연구된 분류군 내에서 P. monogynus, P. opulifolius의 경우에서만 양면기공엽이 확인되었고, Neillia속, Stephanandra 속과 나머지 Physocarpus속 내 분류군에서는 이면기공엽으로 관찰되었다. 대부분의 경우, 기공엽의 유형은 속 내 종 수준에서 일관성있게 나타나는 것이 일반적이나, 몇몇 분류군의 경우 속 내에서도 기공엽 유형의 종간 차이가 나타나 구별된다(Adeniji and Ariwaodo, 2012). 본 형질로 Neillia속, Stephanandra속의 유사성뿐만 아니라, Physocarpus속 내 종을 구분하는 인식형질로서의 가능성을 확인하였다. 한편, 일반적으로 양면기공엽을 나타내는 경우, 배축면의 밀도가 향축면보다 높은 것으로 알려져 있는데(Esau, 1977), 본 연구에서 역시 양면기공엽을 나타내는 두 분류군(P. monogynus, P. opulifolius)의 경우, 배축면의 밀도가 높게 나타나 일반적인 양면기공엽의 밀도 패턴으로 확인되었다.
기공복합체 유형의 경우, 평행형이 나타나는 Neillia affinis을 제외하면, 족 내 모든 분류군에서 불규칙형으로 일관성있게 확인된다. 피자식물군 내에서 기공복합체 유형에 대한 계통진화학적 해석은 아직까지 불분명한 것으로 나타난다(Cronquist, 1981). 따라서, 본 형질에 대한 계통학적 해석에는 무리가 있으나, 족 내 일관성있게 나타나는 형질임을 확인할 수 있었다.
표피세포의 미세형태 및 표피상납질의 유무표피세포를 통해 확인할 수 있는 다양한 형질은 분류학적으로 가치있는 정보를 제공한다(Barthlott, 1981; Stace, 1984). 본 연구 결과, 표피세포의 다양한 형질 중 수층벽과 병층벽의 형태가 유용함을 확인하였는데, Neillia속의 경우 모든 분류군에서 등방형의 세포는 향축면에서 직선형/곡선형, 배축면에서 파상형으로 일관성있게 나타났으며, Stephanandra속의 경우 양면에서 파상형이 나타나 구별되었다. 한편, 병층벽의 경우 Stephanandra속의 배축면에서 볼록하게 나타났고, 섬국수나무(P. insularis)에서만 배축면에 유두상 세포로 확인되어 족 내 다른 분류군과 유일하게 구별되었다.
표피상납질은 다양한 식물군 내에서 독특한 형태로 나타나며, 표피상납질의 유무와 유형에 대한 형질은 분류학적으로 매우 유용한 것으로 알려져 있다(Wilkinson, 1979; Barthlott et al., 1998; Barthlott et al., 2003; Ensikat et al., 2006). 본 연구에서는 판형의 표피상납질이 N. affinis, S. tanakae 두 분류군에서만 확인되었다. 표피상납질은 서식지의 환경적, 생태적 영향을 많이 받는다고 보고된 바 있고(Agrawal et al., 2009), 특히 건조한 서식환경에서 증산작용으로 인한 수분 손실로부터 표피저항성을 높이기 위한 전략으로 발달한다고 알려져 있다(Oliveira et al., 2003; Rotondi et al., 2003). 본 형질은 족 내 종 동정으로 유용함이 밝혀졌으나, 추후 서식지와 관련하여 줄기, 엽병 등 식물체 전체에서의 표피상납질 분포 및 종류에 대한 보다 심도있는 연구가 필요할 것으로 판단된다.
모용의 유형본 연구 분류군에서는 크게 4종류의 모용이 확인되었으며, 관찰된 모용의 유형은 일부 속간, 종간 진단형질로서 유용성이 있음이 밝혀졌다. 현화식물군 내 잎 표피에서 나타나는 모용은 비교 계통학적 연구에서 상당히 중요한 역할을 해왔고, 다양한 분류군 내에서 분류학적 유용성이 확인되었다(Theobald et al., 1979). 특히, 장미과 내에서는 많은 연구 결과를 통해 잎 표피에서 확인할 수 있는 모용 형태의 분류학적 유용성이 이미 검증되었다(Eriksen and Yurstev, 1999; Kolodziejek, 2008; Faghir et al., 2010; Ganeva and Uzunova, 2010; Heo et al., 2013; Faghir et al., 2014; Song and Hong, 2016). 본 연구에서 확인된 모용은 Theobald et al. (1979)이 제시한 형태를 기반으로, 크게 4종류, subtype을 포함, 총 7종류로 구분하였다. 특히, 나도국수나무족내에서는 2−5개 가지상 모용(armed trichome)과 성상모(PS, MN)의 유무가 분류학적으로 매우 유용하였다. 일반적으로 2−5개 가지상 모용은 가지의 개수에 따라 크게 2개의 가지, 3개에서 5개의 가지상 모용으로 구분된다. 또한, 2개의 가지로 된 모용의 경우, 그룹 내에서 진단형질로 유용하며, 3−5개 가지상 모용은 일반적으로 더 다양하고, 성상모와 수지상(dendritic type) 모용과 연관이 있다고 알려져 있다(Theobald et al., 1979).
본 연구에서는 가지의 개수와 형태에 따라 크게 2−5개 가지상 모용과 6개 이상의 가지로 구성된 별 모양(star-shaped) 의 성상모로 구분하였다. 연구된 분류군 내에서 2−5개 가지상 모용은 P. malvaceus, P. monogynus에서만 나타났으며, 두 타입의 성상모(PS, MN)는 섬국수나무(P. insularis)를 제외한 Physocarpus속 모든 분류군에서 확인되었다. 따라서, 성상모의 유무는 족 내 Physocarpus속을 구분하는 매우 유용한 형질임이 밝혀졌고, 2−5개 가지상 모용은 속 내 종 동정에 유용함이 확인되었다. 또한, 섬국수나무는 긴 단세포단모(LS)만이 확인되어, Physocarpus속 내 나머지 분류군과 상이한 차이를 나타냈다.
계통학적 유용성(systematic implication)최근 주사전자현미경을 이용하여 관찰된 잎 표피 미세형질을 분자계통수와 비교하여, 형질의 계통학적 유용성을 밝히는 연구가 이루어지고 있다(Moon et al., 2009, 2010; Liu et al., 2010). 따라서, 생식형질뿐 아니라 영양형질 중 잎 표피에서도 분류학적, 계통학적으로 유용성있는 형질을 탐색할 수 있다. 나도국수나무족에 대한 분자계통학적 연구에서는 본 족을 Neillia속과 Stephanandra속의 통합을 통해, Neillia속, Physocarpus속 두 속으로 제안하고 있으며(Oh and Potter, 2003, 2005; Oh, 2006, 2015, 2016; Potter et al., 2007), 섬국수나무(P. insularis)의 분류학적 위치를 Spiraea속으로 전속하여 S. insularis로의 재조합을 제안하고 있다(Oh et al., 2010, Shin et al., 2011). 최근 수행된 본 족의 미세형태학적 형질 중 화분학적 형질의 연구결과에 따르면, 정량적 형질을 포함하여 크게 유공상(perforate)인 Neillia속, Stephanandra속과 유선상(striate)인 Physocarpus속으로 구분하여 분자계통학적 연구결과를 지지할 뿐 아니라, 화분 표면 무늬의 계통학적 유용성까지 밝힌 바 있다(Song et al., 2017a).
영양기관인 잎 표피 미세형질에 대한 본 연구에서는 기공복합체의 형태, 표피세포의 유형, 모용의 형태 형질에서 계통학적 유용성을 확인할 수 있었다. 기공복합체의 경우, Neillia속, Stephanandra속에서 이면기공엽이 일관성 있게 나타났고, Physocarpus속에서는 이면기공엽과 양면기공엽을 지닌 분류군이 함께 나타나 구별되었다. 또한, 모용의 경우 Physocarpus속에서만 성상모가 나타나, 성상모가 나타나지 않는 Neillia속, Stephanandra속과 구별되며, 이들 두 속의 유사성을 나타내는 형질임을 확인할 수 있었다.
한편, 본 연구 결과 섬국수나무는 족 내 다른 분류군과 매우 상이한 형질패턴을 나타냈다. 표피세포의 경우, 섬국수나무에서만 유두상의 표피세포 형태가 확인되었고, Physocarpus속 내 분류군임에도 불구하고, 속 내에서 일관성있게 나타나는 성상모 역시 나타나지 않았다. 최근 수행된 조팝나무족(Spiraeeae)의 잎 표피 미세형태형질 연구에서는 Spiraea속 내 일부 분류군에서 유두상의 표피세포와 단세포 단모가 나타나며, 성상모는 속 내 분류군 모두에서 일관성있게 나타나지 않음이 밝혀졌다(Song, 2016). 또한, 화분학적 형질을 통해서는 섬국수나무가 유선상의 화분 표면무늬(Physocarpus속 유공상; Spiraea속 유선상)를 지니고, 포분질(sporopollenin)로 이루어진 소구상체(orbicules)가 약실 내벽에 존재하지 않는 특징(Physocarpus속 소구상체 존재; Spiraea속 소구상체 부재)을 지녀, Spiraea속 내 분류군과 유사한 것으로 나타났다(Song et al., 2017a, 2017b). 따라서, 관찰된 일부 잎 표피 미세형태학적 형질 역시 섬국수나무가 Spiraea속 분류군과 유사함을 나타내는 추가적인 형질로 판명되었으며, 분류학적 위치를 Spiraea속으로 전속하여 Spiraea insularis로 인식한 Oh et al. (2010)의 분자계통학적 연구 결과를 지지하였다.
결론적으로, 주사전자현미경을 이용한 나도국수나무족 3속 15분류군의 잎 표피 미세형태학적 형질 중, 기공복합체 유형, 표피세포 형태, 표피상납질의 유무, 모용의 형태 등의 형질이 족 내 속, 종 수준에서 식별형질로서 유용함을 밝혔다. 또한, 분자계통학적 연구 결과와의 비교 고찰을 통해 Stephanandra속의 Neillia속으로의 통합, 섬국수나무(Physocarpus insularis)의 Spiraea속으로의 전속(Spiraea insularis)에 대한 타당성을 확인함과 동시에 기공복합체의 형태, 유두상 표피세포의 유무, 성상모의 유무 형질의 계통학적 유용성을 확인하였다.
ACKNOWLEDGMENTSThe authors would like to thank the directors of the herbaria of KB, KHUS, and WU for permitting the examination of specimens through loans. Two anonymous reviewers, whose comments and corrections raised the work, are also acknowledged. This study is a part of the Ph.D. dissertation of the first author (J.-H. Song) and is supported by the Basic Science Research Program through the National Research Foundation of Korea (NRF) funded by the Ministry of Education, Sciences and Technology (NRF-2012R1A1A200 4149) to S.-P. Hong.
Fig 1.Scanning electron microscope micrographs of leaf surfaces of tribe Neillieae. A−C. Neillia affinis. A. Abaxial surface showing undulate anticlinal walls with paracytic stomata. B. Adaxial surface showing straight and curved epidermal cells with striation fine relief. C. Platelets epicuticular waxes deposit at the adaxial surface. D, E. Neillia sinensis var. sinensis. D. Adaxial surface showing isodiametric epidermal cells. E. Adaxial surface showing undulate anticlinal walls with striation fine relief. F. Neillia thibetica var. thibetica. Adaxial surface showing straight and curved epidermal cells. G. Neillia uekii. Abaxial surface showing undulate anticlinal walls with anomocytic stomata. H. Physocarpus amurensis. Abaxial surface showing undulate anticlinal walls with anomocytic stomata. I−K. Physocarpus insularis. I, J. Abaxial surface showing curved anticlinal walls and papillate periclinal walls with anomocytic stomata. K. Adaxial surface showing straight and curved epidermal cells with smooth fine relief. L. Physocarpus monogynus. Adaxial surface showing undulate anticlinal walls with anomocytic stomata. 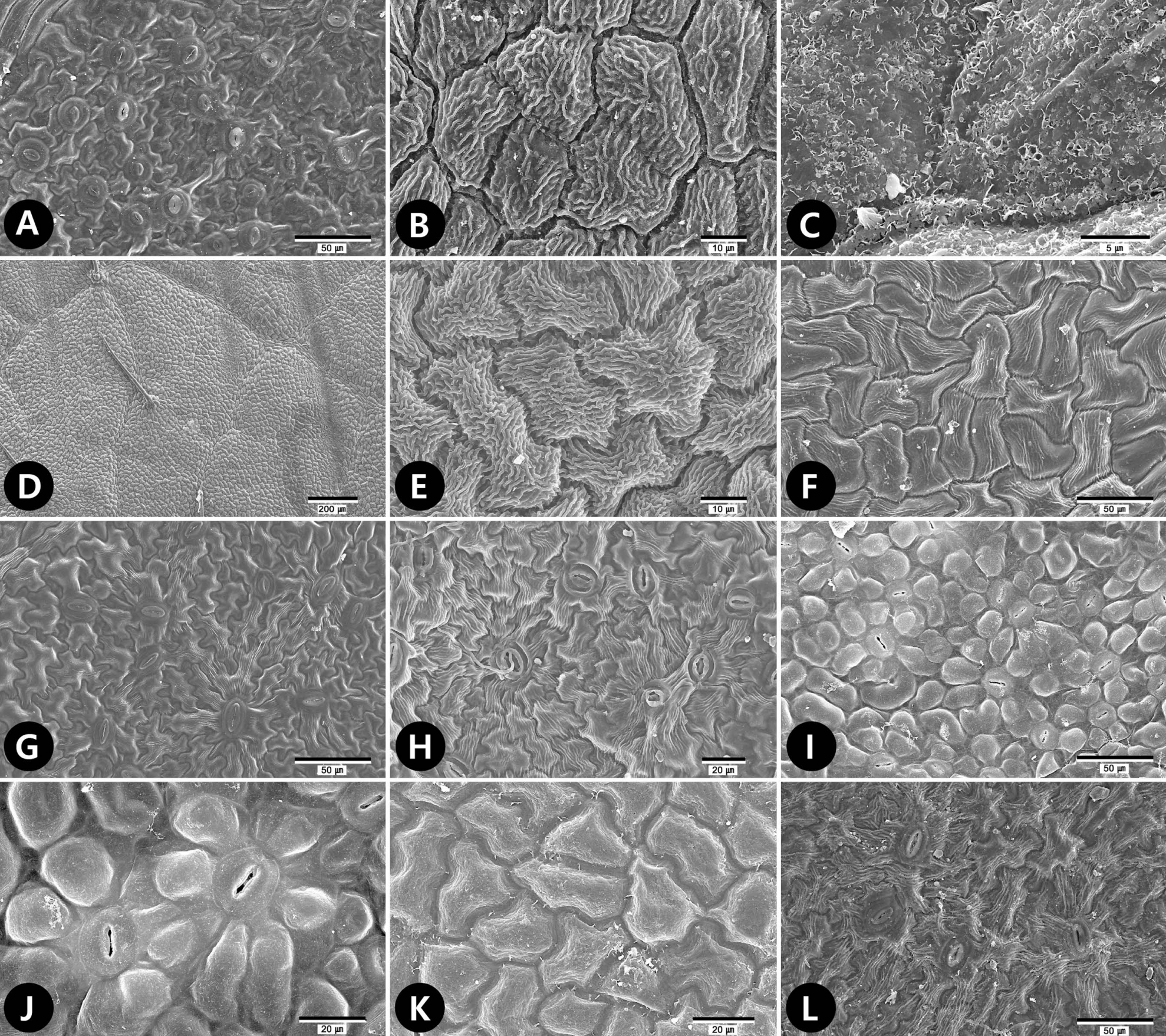
Fig 2.Scanning electron microscope micrographs of leaf surfaces of tribe Neillieae. A, B. Physocarpus opulifolius. A. Abaxial surface showing anomocytic stomata. B. Adaxial surface showing anomocytic stomata. C−E. Stephanandra tanakae. C. Abaxial surface showing anomocytic stomata. D. Abaxial surface showing undulate anticlinal walls with striation fine relief. E. Adaxial surface showing platelets epicuticular waxes. F. Stephanandra incisa. Abaxial surface showing anomocytic stomata. 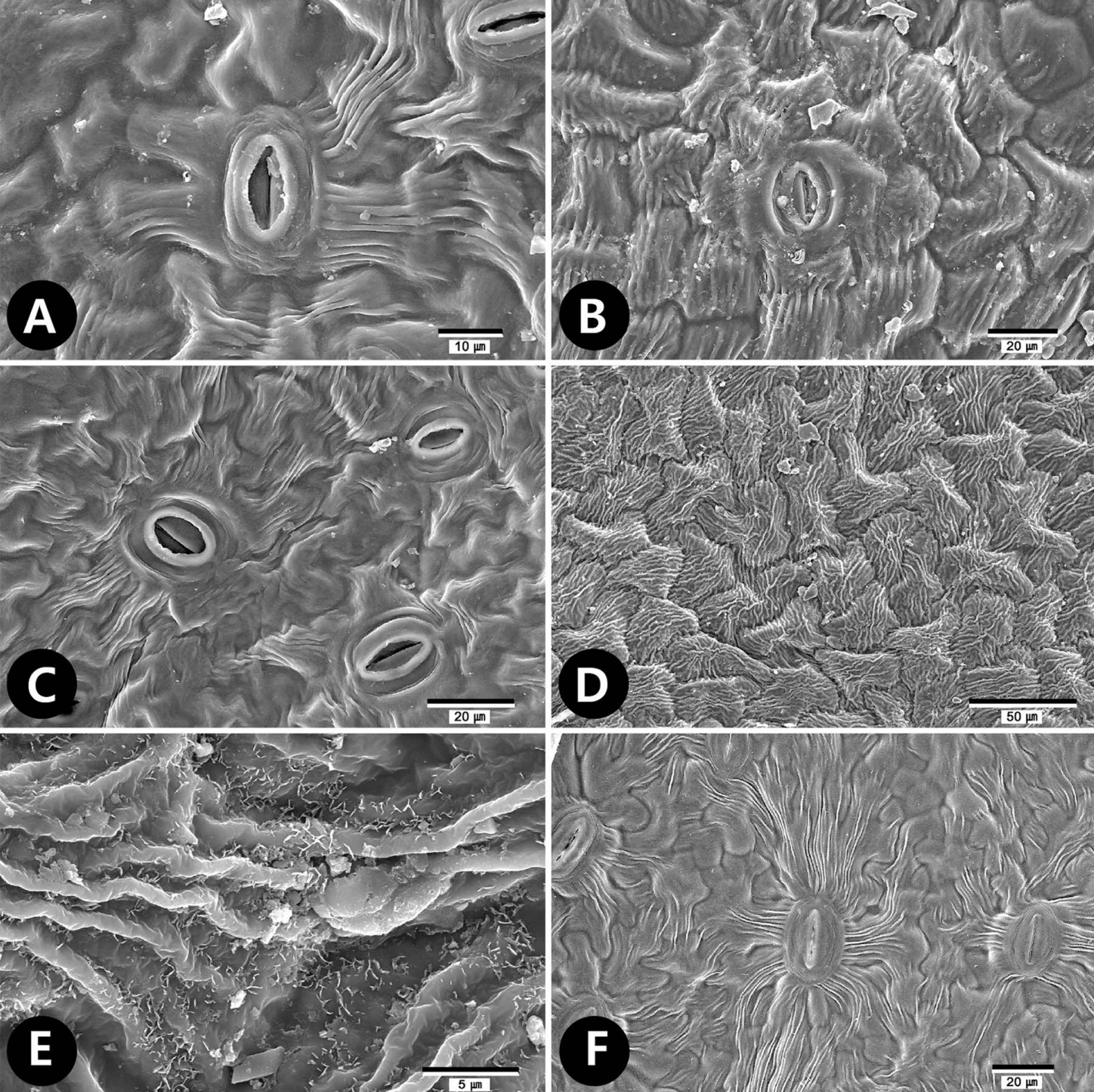
Fig 3.Scanning electron microscope micrographs of trichomes of tribe Neillieae. A. Neillia affinis. Capitate glandular trichome (type 4-1). B. Neillia gracilis. Distribution of long trichome (>100 µm, LS, type 1-2) at adaxial surface. C−E. Neillia sinensis var. sinensis. C. Distribution of LS (type 1-2) at abaxial surface mid vein. D, E. Unicellular LS (type 1-2) of adaxial surface. F−H. Neillia sinensis var. hypomalaca. F. Trichome surface showing smooth wall. G. Each arrows indicate short trichome (SS, type 1-1), LS (type 1-2), and subsessile glandular trichome (S, type 4-2) at abaxial surface, respectively. H. Distribution of LSs (type 1-2) at adaxial surface. I. Neillia thibetica var. thibetica. Distribution of LS (type 1-2) at abaxial surface mid vein. J. Neillia thibetica var. lobata. SS (type 1-1) and LS (type 1-2) at adaxial surface. K. Neillia thyrsiflora. S (type 4-2) at abaxial surface. L. Neillia uekii. LS (type 1-2) at adaxial surface. 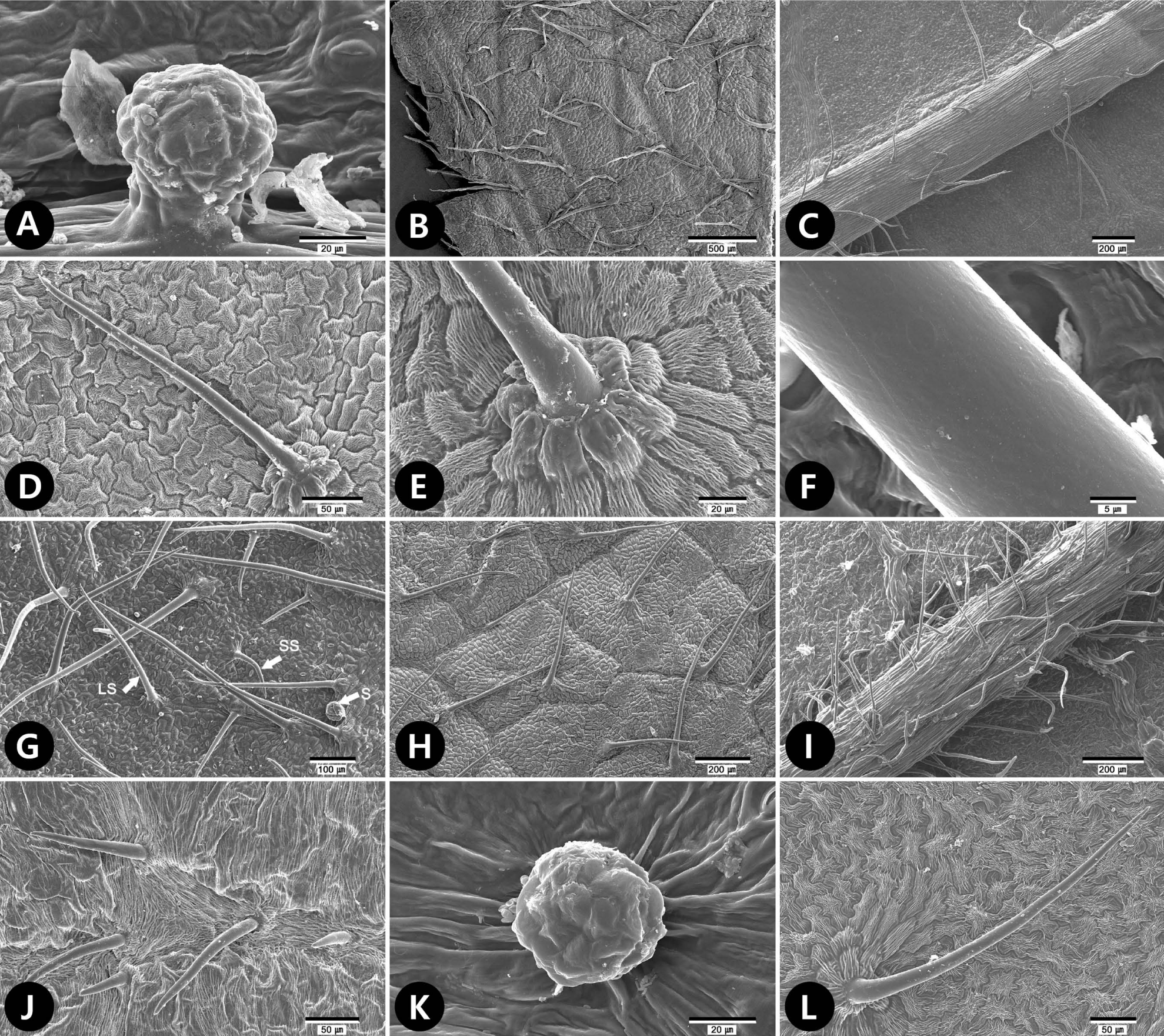
Fig 4.Scanning electron microscope micrographs of trichomes of tribe Neillieae. A. Physocarpus amurensis. Multi-angulate stellate trichome (MN, type 3-2). B−F. Physocarpus malvaceus. B. Two armed trichome (AM, type 2). C. Distribution of porrect-stellate trichome (PS, type 3-1) and MNs (type 3-2) at abaxial surface. D. MN (type 3-2) with stalk (stk) at abaxial surface. E. MN (type 3-2) at adaxial surface. F. Capitate glandular trichome (type 4-1) abaxial surface. G−J. Physocarpus monogynus. G. Four AM (type 2) at adaxial surface. H. Four AM (type 2) at abaxial surface. I. Porrect-stellate trichome (PS, type 3-1). J. Distribution of PS (type 3-1) and MN (type 3-2) at abaxial surface. K, L. Stephanandra incisa. K. Distribution of short (SS, type 1-1), long trichomes (LS, type 1-2), and subsessile glandular trichome (S, type 4-2) at abaxial surface. L. LSs (type 1-2) at adaxial surface. 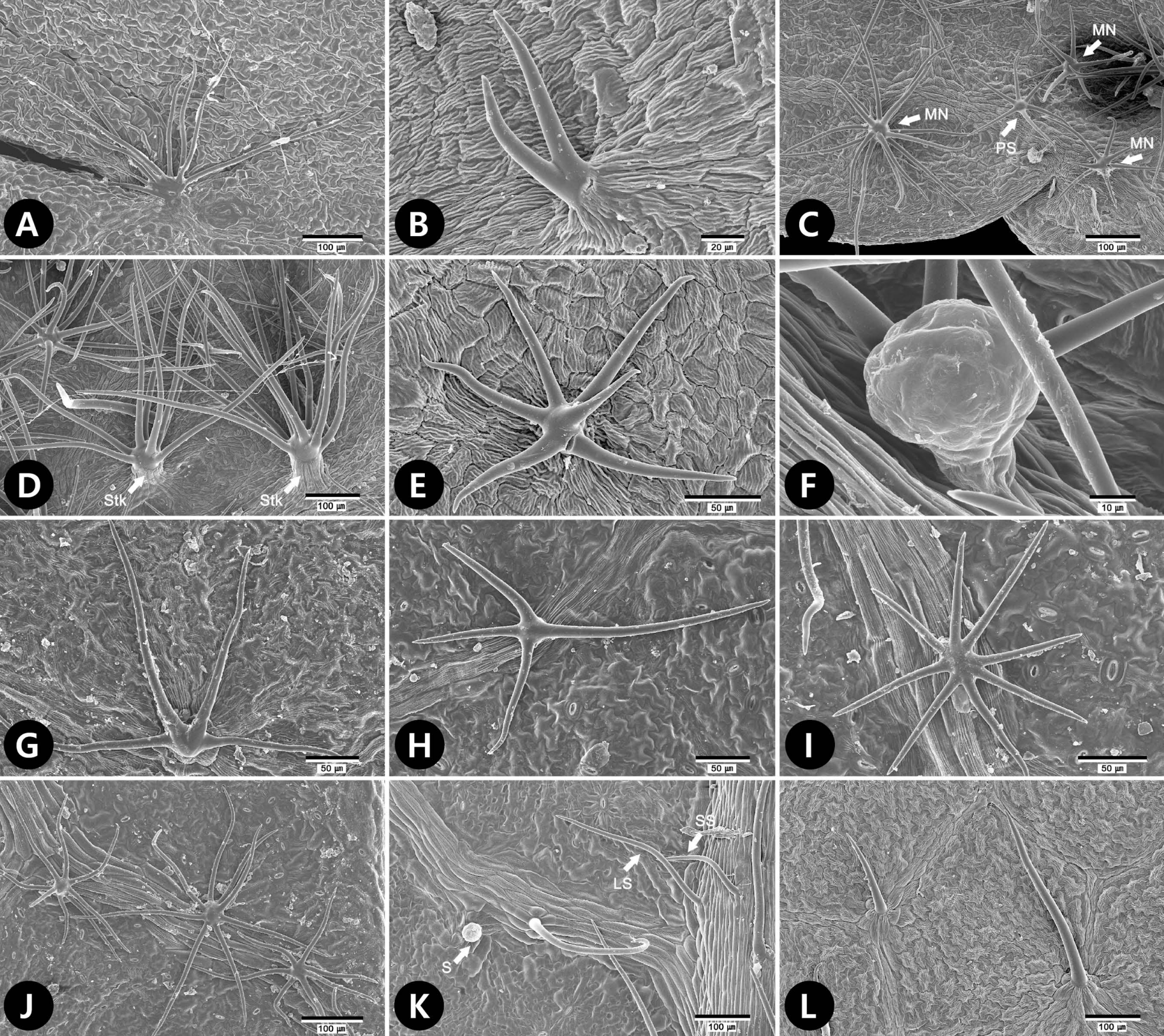
Table 1.Overview of representative stomatal characters on leaves of all taxa studied in the tribe Neillieae.
Table 2.Overview of representative leaf epidermal surface micromorphological characters, kinds of trichomes and epicuticular waxes on leaves of all taxa studied in the tribe Neillieae. Outline: iso, isodiametric. Anticlinal wall: st, straight; cur, curved; und, undulate. Periclinal wall: cv, convex; ft, flat; pa, papillate. Fine relief: sm, smooth; st, striation. Trichome: SS, short unicellular non-glandular trichome; LS, long unicellular non-glandular trichome; AM, two- to five-armed trichome; PS, sessile porrect-stellate trichome; MN, sessile multi-angular stellate trichome; C, capitate gland; S, subsessile gland. Epicuticular wax: pt, platelets. AB, abaxial side; AD, adaxial side; -, absent; +, present; ++, dominance; +++, more dominance. Literature CitedAdeniji, K.A. and Ariwaodo., J.O.. 2012. Comparative foliar epidermal studies of genus Pericopsis (Papilionaceae) in Nigeria. Phytologia Balcanica 18: 37-41.
Agrawal, A. A.. Fishbein, M.. Jetter, R.. Salminen, J. P.. Goldstein, J. B.. Freitag, A. E. and Sparks, J. P.. 2009. Phylogenetic ecology of leaf surface traits in the milkweeds (Asclepias spp.): chemistry, ecophysiology, and insect behavior. New Phytologist 183: 848-867.
Anil Kumar, V.S. and Murugan., K.. 2013. Taxonomic significance of foliar micromorphology and their systematic relevance in the genus Solanum (Solanaceae). In Prospects in Bioscience: Addressing the Issues. Sabu, A.. Augustine, A. (eds.), Springer, New Delhi. 343-349.
Barthlott, W.. 1981. Epidermal and seed surface characters of plants: systematic applicability and some evolutionary aspects. Nordic Journal of Botany 1: 345-355.
Barthlott, W.. Neinhuis, C.. Cutler, D.. Ditsch, F.. Meusel, I.. Theisen, I. and Wilhelmi, H.. 1998. Classification and terminology of plant epicuticular waxes. Botanical Journal of the Linnean Society 126: 237-260.
Barthlott, W.. Theisen, I.. Borsch, T. and Neinhuis, C.. 2003. Epicuticular waxes and vascular plant systematics: integrating micromorphological and chemical data. In Deep Morphology: Toward a Renaissance of Morphology in Plant Systematics. Stuessy, T. F.. Mayer, V.. Hörandl, E. (eds.), ARG Gantner Verlag, Ruggell. 189-206.
Bentham, G. and Hooker., J.D.. 1865. Genera Plantarum, Vol. 1. William Pamplin, London. 516 pp.
Cronquist, A.. 1981. An Integrated System of Classification of Flowering Plants. Columbia University Press, New York. 1262 pp.
Dahlgren, R.M.T.. 1980. A revised system of classification of the angiosperms. Botanical Journal of the Linnean Society 80: 91-124.
De Sá-Haiad, B.. Serpa-Ribeiro, A. C. C.. Barbosa, C.N.. Pizzini, D.. Leal, D. D. O.. de Senna-Valle, L. and De Santiago-Fernandes, L. D. R.. 2009. Leaf structure of species from three closely related genera from tribe Crotoneae Dumort. (Euphorbiaceae s.s., Malpighiales). Plant Systematics and Evolution 283: 179-202.
Deng, M.. Hipp, A.. Song, Y.-G.. Li, Q.-S.. Coombes, A. and Cotton, A.. 2014. Leaf epidermal features of Quercus subgenus Cyclobalanopsis (Fagaceae) and their systematic significance. Botanical Journal of the Linnean Society 176: 224-259.
Ensikat, H.J.. Boese, M.. Mader, W.. Barthlott, W. and Koch, K.. 2006. Crystallinity of plant epicuticular waxes: electron and X-ray diffraction studies. Chemistry and Physics of Lipids 144: 45-59.
Eriksen, B. and Yurstev., B.A.. 1999. Hair types in Potentilla sect. Niveae (Rosaceae) and related taxa, terminology and systematic distribution. Norske Videnskaps-Akademi Matematisk.-Naturvidenskapelig Klasse 38: 201-221.
Esau, K.. 1977. Anatomy of Seed Plants. 2nd ed. John Wiley and Sons, New York. 576 pp.
Faghir, M.B.. Attar, F.. Farazm, A.. Ertter, B. and Eriksen, B.. 2010. Leaf indumentum types in Potentilla (Rosaceae) and related genera in Iran. Acta Societatis Botanicorum Poloniae 79: 139-145.
Faghir, M.B.. Chaichi, K.K. and Shahvon, R.S.. 2014. Foliar epidermis micromorphology of the genus Alchemilla (Rosaceae) in Iran. Phytologia Balcanica 20: 215-225.
Ganeva, T. and Uzunova., K.. 2010. Comparative leaf epidermis study in species of genus Malus Mill. (Rosaceae). Botanica Serbica 34: 45-49.
Greene, E.L.. 1889. The North American Neilliæ. Pittonia 2: 25-31.
Heo, K.I.. Lee, S.R.. Yoo, M.H.. Lee, S.T.. Kwon, Y.. Lim, S.Y.. Kim, S.H. and Kim, S.C.. 2013. The taxonomic implication of trichome and epicuticular waxes in tribe Potentilleae (Rosaceae) in Korea. Korean Journal of Plant Taxonomy 43: 106-117 (in Korean).
Husain, S.Z.. Marin, P.D.. Šili, Č.. Qaiser, M. and Petcovi, B.. 1990. A micromorphological study of some representative genera in the tribe Saturejeae (Lamiaceae). Botanical Journal of the Linnean Society 103: 59-80.
Jones, M.E.. 1893. Contributions to western botany. Zoe 4: 38-45.
Kalkman, C.. 2004. Rosaceae. In The Families and Genera of Vascular Plants, Vol. 6. Flowering Plants - Dicotyledons: Celastrales, Oxalidales, Rosales, Cornales, Ericales. Kubitzki, K. (ed.), Springer-Verlag, Berlin. 343-386.
Kim, C.H.. Kim, T.J. and Sun, Y.. 2000. Taxonomic identities of some endemic Korean vascular plants. Korean Journal of Plant Taxonomy 30: 355-361 (in Korean).
;odziejek, J.. 2008. Hair types in Polish selected taxa of Potentilla subsect. Collinae (Rosaceae). Acta Societatis Botanicorum Poloniae 77: 217-224.
Kuntze, O.. 1891. Revisio Generum Plantarum, Parts 1. Arthur Felix, Leipzig. 374 pp.
Liu, Q.. Zhang, D.X. and Peterson, P.M.. 2010. Lemma micromorphological characters in the Chloridoideae (Poaceae) optimized on a molecular phylogeny. South African Journal of Botany 76: 196-209.
Ma, Q.-W.. Li, C.-S.. Li, F.-L. and Vickulin, S.V.. 2004. Epidermal structures and stomatal parameters of Chinese endemic Glyptostrobus pensilis (Taxodiaceae). Botanical Journal of the Linnean Society 146: 153-162.
Maximowicz, C.J.. 1879. Adnotationes de Spiraeaceis. Trudy Imperatorskago S.-Peterburgskago Botanicheskago Sada 6: 105-261.
Moïse, J.A.. Han, S.. Gudynaite˛-Savitch, L.. Johnson, D.A. and A. Miki, B.L.. 2005. Seed coats: structure, development, composition, and biotechnology. In Vitro Cellular & Developmental Biology–Plant 41: 620-644.
Moon, H.-K.. Hong, S.-P.. Smets, E. and Huysmans, S.. 2009. Phylogenetic significance of leaf micromorphology and anatomy in the tribe Mentheae (Nepetoideae: Lamiaceae). Botanical Journal of the Linnean Society 160: 211-231.
Moon, H.-K.. Smets, E. and Huysmans, S.. 2010. Phylogeny of tribe Mentheae (Lamiaceae): the story of molecules and micromorphological characters. Taxon 59: 1065-1076.
Morgan, D.R.. Soltis, D.E. and Robertson, K.R.. 1994. Systematic and evolutionary implications of rbcL sequence variation in Rosaceae. American Journal of Botany 81: 890-903.
Oh, S.-H.. 2015. Taxonomy of tribe Neillieae (Rosaceae): Physocarpus. Korean Journal of Plant Taxonomy 45: 332-352.
Oh, S.-H.. 2016. Taxonomy of tribe Neillieae (Rosaceae): Neillia. Korean Journal of Plant Taxonomy 46: 13-32.
Oh, S.-H. and Potter., D.. 2003. Phylogenetic utility of the second intron of LEAFY in Neillia and Stephanandra (Rosaceae) and implications for the origin of Stephanandra. Molecular Phylogenetics and Evolution 29: 203-215.
Oh, S.-H. and Potter., D.. 2005. Molecular phylogenetic systematics and biogeography of tribe Neillieae (Rosaceae) using DNA sequences of cpDNA, rDNA, and LEAFY. American Journal of Botany 92: 179-192.
Oh, S.-H.. Chen, L.. Kim, S.-H.. Kim, Y.-D. and Shin, H.. 2010. Phylogenetic relationship of Physocarpus insularis (Rosaceae) endemic on Ulleung Island: implications for conservation biology. Journal of Plant Biology 53: 94-105.
Oliveira, A.F.M.. Meirelles, S.T. and Salatino, A.. 2003. Epicucticular waxes from caatinga and cerrado species and their efficiency against water loss. Anais da Academia Brasileira de Ciências 75: 431-439.
Potter, D.. Gao, F.. Bortiri, P.E.. Oh, S.-H. and Baggett, S.. 2002. Phylogenetic relationships in Rosaceae inferred from chloroplast matK and trnL-trnF nucleotide sequence data. Plant Systematics and Evolution 231: 77-89.
Potter, D.. Eriksson, T.. Evans, R.C.. Oh, S.. Smedmark, J. E. E.. Morgan, D.R.. Kerr, M.. Robertson, K.R.. Arsenault, M.. Dickinson, T.A. and Campbell, C.S.. 2007. Phylogeny and classification of Rosaceae. Plant Systematics and Evolution 266: 5-43.
Rehder, A.. 1940. The Manual of Cultivated Trees and Shrubs Hardy in North America Exclusive of the Subtropical and Warmer Temperate Regions. 2nd ed. Macmillan, New York. 996 pp.
Robertson, K.R.. 1974. The genera of Rosaceae in the southeastern United States. Journal of the Arnold Arboretum 55: 303-332.
Rotondi, A.. Rossi, F.. Asunis, C. and Cesaraccio, C.. 2003. Leaf xeromorphic adaptations of some plants of a coastal Mediterranean macchia ecosystem. Journal of Mediterranean Ecology 4: 25-35.
Schulze-Menz, G.K.. 1964. Rosaceae. In Engler’s Syllabus der Pflanzenfamilien II. 12th ed. Melchior, H. (ed.), Gebrüder Borntraeger, Berlin. 209-218.
Shin, H.. Kim, Y.-D. and Oh, S.-H.. 2011. A new combination in Spiraea (Rosaceae) from Ulleung Island, Korea. Novon 21: 373-374.
Song, J.-H.. 2016. Systematic studies in Spiraeoideae (Rosaceae). Ph.D. dissertation, Kyung Hee University; Seoul, Korea. 335.
Song, J.-H. and Hong., S.-P.. 2016. Taxonomic significance of the leaf micromorphology in the tribe Sorbarieae (Spiraeoideae: Rosaceae). Korean Journal of Plant Taxonomy 46: 199-212 (in Korean).
Song, J.-H.. Moon, H.-K.. Oak, M.-K. and Hong, S.-P.. 2017a. Phylogenetic evaluation of pollen and orbicule morphology in the Rosaceae tribe Neillieae (subfamily Amygdaloideae). Botanical Journal of the Linnean Society 183: 439-453.
Song, J.-H.. Oak, M.-K.. Roh, H.-S. and Hong, S.-P.. 2017b. Morphology of pollen and orbicules in the tribe Spiraeeae (Rosaceae) and its systematic implications. Grana 56: 351-367.
Stace, C.A.. 1984. The taxonomic importance of the leaf surface. In Current Concepts in Plant Taxonomy. Heywood, V. H.. Moore, D. M. (eds.), Academic Press, London. 67-93.
Taia, W.K.. 2004. Leaf characters within tribe Trifolieae (family Leguminosae). Pakistan Journal of Biological Sciences 7: 1463-1472.
Takhtajan, A.. 1997. Diversity and Classification of Flowering Plants. Columbia University Press, New York. 620 pp.
Theobald, W.L.. Krahulik, J.L. and Rollins, R.C.. 1979. Trichome description and classification. In Anatomy of the Dicotyledons. 2nd ed. Vol. I.: Metcalfe, C. R.. Chalk, L. (eds.), Clarendon Press, Oxford. 40-53.
Thiers, B.. 2017. (Continuously updated) Index Herbariorum: a global directory of public herbaria and associated staff. New York Botanical Garden’s Virtual Herbarium; Retrieved Sep. 1, 2016, Available from http://sweetgum.nybg.org/ih/.
Vidal, J.. 1963. Le genre Neillia (Rosaceae). Adansonia 3: 142-166.
Wilkinson, H.P.. 1979. The plant surface (mainly leaf). In Anatomy of the Dicotyledons. 2nd ed. Vol. I: Metcalfe, C. R.. Chalk, L. (eds.), Clarendon Press, Oxford. 97-165.
APPENDICESAppendix 1.Voucher specimens of tribe Neillieae that are examined in the present study.Symbols †currently transferred from Physocarpus to Spiraea by Shin et al. (2011) and *proposed members of Stephanandra combined into Neillia by Oh (2006, 2016). Herbarium acronyms follow Index Herbariorum (Thiers, 2017) [continuously updated] http://sweetgum.nybg.org/science/ih/. |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||